Struktura, vlastnosti a změny skupenství pevných látek
Pevné látky
a) krystalické – pravidelné uspořádání stavebních částic
monokrystaly – mají pravidelné uspořádání v celém krystalu
(NaCl, CaCO3, SiO2)
polykrystaly – obsahují nahodile uspořádaná zrna, která jsou uvnitř pravidelně uspořádána. (zemina, prach, kovy), jsou izotropní
b) amorfní – beztvaré (asfalt, vosk, sklo, kaučuk)
polymery – bílkoviny, org. původ
izotropie- ve všech směrech má látka stejné vlastnosti (polykrystalické látky)
anizotropie – nejsou stejné vlastnosti (monokrystalické látky)
geometrická mřížka – soustava rovnoběžek v prostoru, rozdělí krystal na soustavu rovnoběžnostěnů
ideální geometrická mřížka je mřížka pravidelně obsazená částicemi
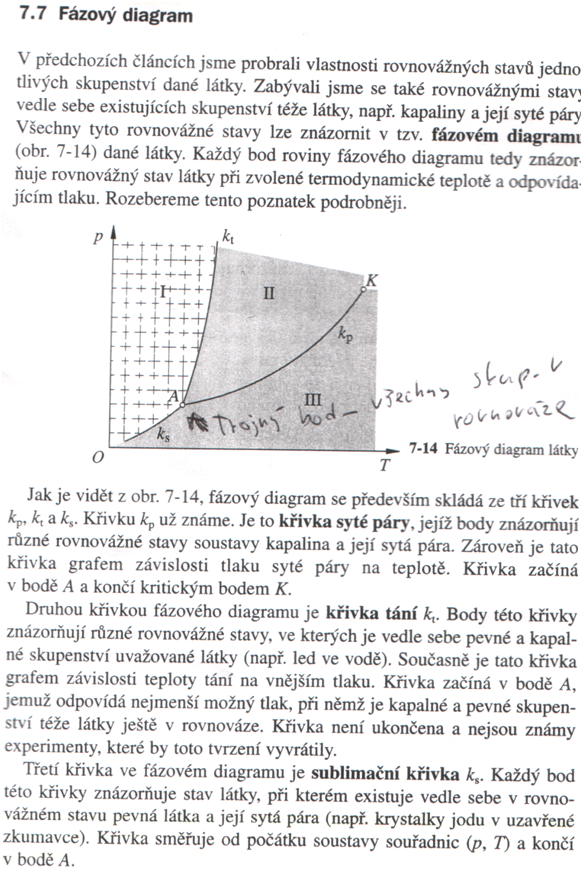
– podle tvarů rovnoběžnostěnů rozlišujeme tzv. krystalografické soustavy – soustava krychlová (kubická) – elementární (základní) buňka je krychle
1) primární 2) plošně centrovaná 3) prostorově centrovaná
Vrcholy středy stran střed krychle
– Částice kmitají kolem bodů kryst. mřížky.
mřížkový parametr a- délka hrany krychle
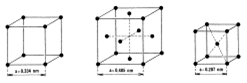
Poruchy (defekty) krystalové mřížky
– v reálném krystalu existuje mnoho poruch od pravidelného uspořádání částic
a) vakance – vzniká neobsazením rovnovážné polohy kryst. mřížky
příčina- tepelný kmitavý pohyb částic -> částice opustí své místo a vzniká neobsazené místo
dostaneme ozářením krystalu – elektrony, neutrony, ionty
b) intersticiální poloha – částice se nachází mimo pravidelný bod krystalické mřížky (v mezeře – )
c) příměsy (nečistota)
– cizí částice se vyskytuje v krystalu daného chem. složení
– nachází se buď v intersticiální poloze (podle počtu částic C v Fe dostaneme různé druhy oceli) nebo nahrazuje vlastní částici mřížky (polovodiče typu P nebo N – příměsi do struktury křemíku)
Typy vazeb
Síly které působí mezi částicemi v krystalické mřížce:
1. Iontová – mřížku drží pohromadě elektrické přitažlivé síly mezi kationty a anionty
2. Kovová – odpudivé elektrické síly kationtů kovu nepustí atomy na novou polohu, elektrony tvoří elektronový plyn mezi kationty – jsou volné
3. Kovalentní – je to chemická vazba mezi atomy, kdy atomy mají společné valenční elektrony; je u izolantů nebo polovodičů (Si, Ge)
4. Molekulová – síly mezi molekulami – je velmi slabá
Deformace pevného tělesa
tvárná (plastická) – přestaneme-li působit silou, deformace zůstává
pružná (elastická) – vrací se do původního tvaru, je dočasná
deformace tělesa = změna tvaru, objemu i rozměrů působením vnější síly
a) deformace tahem![]()
F = -F
– roztahování – výtah jeřáb
b) deformace tlakem ![]()
F = -F
– stlačování – pilíře, nosníky
c) deformace ohybem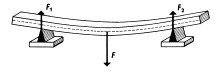
F – síla, působící vahou toho tělesa
– horní vrstva se deformuje tlakem
– spodní vrstva se deformuje tlakem
– prostřední část zůstává nezměněna
d) deformace smykem
– posunutí vrstev, vzdálenost vrstev se nemění (šroub, nýt)
e) deformace kroucením – obsahuje 2 soustavy sil, vrták při vrtání, šrouby při utahování
Síla pružnosti, normálové napětí
– tahové síly vyvolávající sílu F
– při deformaci nastává tzv. stav napjatosti, který je charakterizován normálovým napětím – Sigma n [Pa]
![]() síla pružnosti, která působí na příčný řez o obsahu S/ obsah plochy (v tab u Hoodova zákona na konci F / S)
síla pružnosti, která působí na příčný řez o obsahu S/ obsah plochy (v tab u Hoodova zákona na konci F / S)
(Fp = m g)
– ve stavu rovnováhy : F = -F
mez pevnosti – sp, sp < Sigma n ==> poruší se soudržnost (přetrhnutí)
→ tab. str. 139
– křehké látky mají mez pevnosti blízko meze pružnosti (sklo)
mez pružnosti (elasticity) – sE – max. hodnota Sigma n, kdy zůstává deformace pružná (pak už trvalá)
dovolené napětí – sD – max. hodnota Sigma n, kdy při deformaci (tahem, tlakem) jde o pružnou deformaci. Podíl meze pevnosti a dovoleného napětí je součinitel (koeficient) bezpečnosti.
Př.:
d=?
m = 2,5t
Sigma n = 60 MPa
Sigma n = mg / pi d2 / 4
d2 = 4 mg / pi Sigma n = 2,3 cm
Př.: SIgma n = ? [Pa]
F = 0,25 kN
d = 2,1mm
Sigma n = Fp / s
Př.:
d = 15mm = 0,015m
(tyčinka)
F = 1,63 * 105 N….. síla potřebná k jejímu přetržení
Urči mez pevnosti v tahu.
Sigma n = Fp / S
Sigma n = 163000 / pi r2 = 163000 / 0,000176625 = 922 859 165 Pa
Hookův zákon pro pružnou deformaci tahem
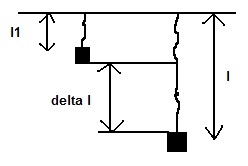
– vyjadřujeme závislost normálového napětí sn a relativního prodloužení epsilon ε
Sigma n = Fp / s
![]()
v tab je, ale není popsát jako ε =!!!
delta l = l – l1 (konečná délka – počáteční délka)
=> prodloužení vůči původní délce. Pokud chceme v procentech, tak ε * 100
Hookův zákon zní: normálové napětí je přímo úměrné relativnímu prodloužení:
Sigma n = E * ε
E… modul pružnosti v tahu (konstanta charakterizuje látku)
– hookův zákon platí pouze pro pružnou deformaci tahem
– je-li E malé, normálové napětí se mění pomalu
ε = 1… prodloužení o vlastní délku
Graf relativního prodloužení:
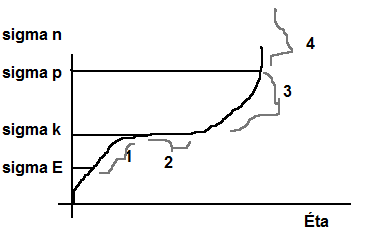
sigma K – mez kluzu
1 – dopružení
2 – látka teče
3 – zpevnění materiálu
4 – roztržení materiálu
– různé materiály mají různé délky částí
Délková, objemová roztažnost
V = V1 [1 + Beta (t – t1)]
– u délkové roztažnosti místo V1 je l1, místo beta je alpha, místo V je l
Beta… součinitel objemové roztažnosti
Aplha… … součinitel délkové roztažnosti
př.: Ocelový drát má při t2=-15C délku 1000m. Urči jeho délku při teplotě 45C
alpha = 11,5 * 10−6 K
l – 1000 * [1 + 11,5 * 10−6 * 60]
l = 1000 * [1 + 690 * 10−6]
l = 1000 * [1,00069] = 1000,7 m
př.: t1 = 20C
V1 = 1 l
delta V = ?
t = 80C
1l = dm3 = 0,001 m3
Beta = 2,4 * 10−5 K−1
V = 0,001 [1 + 2,4 * 10−5 (60)]
V = 0,001 * 1,00144
V = 0,00100144 m3
deltaV = 0,001 – 0,00100144
deltaV = 0,00000144 m3
deltaV = 1,44 cm3
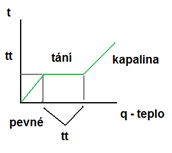
Proces tání
– změna skupenství pevného na kapalné
– většina pevných látek procesem tání zvětšuje svůj objem
– výjimky: led, bismut, germanium – ty táním svůj objem zmenšují
Podmínky uskutečnění tání
a) dosažení teploty tání tt (různá, souvisí s vnějším tlakem)
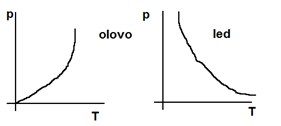
– u ledu se zvyšující teplotou tlak snižuje -> regulace ledu
b) musíme dodávat teplo, než těleso roztaje -> skupenské teplo tání Lt [J] = teplo, které musíme dodat tělesu, zahřátému na teplotu tání Lt, aby se roztálo
Q = m c delta t
c… měrná tepelná kapacita
př.: Q = ? [J]
m = 10 kg
t1 = 20 C
tt = 660 C
c = 896 J kg−1 K−1
lt = 400 K J kg−1
Q1 = m c delta t
Lt = m lt
Q = Q1 + Lt
Q = 10 * 896 * 640 + 10 * 400 000
Q = 57344 * 102 + 4 * 106
Q = 94 344
Př.:
ε = 62% = 0,62
M = 5 t = 5 * 103 kg
E = ?
T1 = 16 C
Tt = 1300 C
C = 460 J kg−1 K−1
Lt = 82 kJ kg−1 = 82 * 103 J kg−1 K−1
ε = Q / E
E = Q / ε
Q = Qz + lt
Q = m c (t1 – 1) + m * lt
Q = 5 * 103 * 460 * (1300 – 16) + 5 * 103 * 82 * 103
Q = 5 * 104 * 46 * (1284) + 5 * 106 * 82
Q = 23 * 105 * 1284 + 41 * 107
Q = 29532 * 105 + 41 * 107 = 33632 * 1-^5 J
Vypařování (koncenzace)
– přeměna kapaliny na plyn
– Probíhá za každé teploty
Urychlíme:
– Zvýšením teploty
– Odvodem par
– Zvětšení plochy
– Skupenské teplo vypařování (varu) – Lv
– Množství tepla, které musíme dodat, aby se látka změnila v páru téže teploty.
– měrné skupenské teplo vypařování (také Lv)
Lv = Lv / m [J Kg−1]
– Lv s rostoucí teplotou klesá
Př.: voda 0C à lv = 2,51 MJ kg−1 … tab. 152
100C à lv = 2,26 MJ kg−1
Var – proces, kdy k vypařování dochází v celém objemu kapaliny (vypařování odevšud)
– Bublinky páry vznikají uvnitř kapaliny
– Je podmíněn teplotou varu
Např.: H2O při normál. atmosférickém tlaku 101 kPa má teplotu varu 100 C
– Teplota varu závisí na vnějším tlaku
– S rostoucím tlakem teplota varu roste, se snižujícím klesá
– Využití: v tlakových nádobách – papinův hrnec
Sublimace
– Proces, při kterém se pevná látka přímo mění na plyn
– Sublimuje např.: sníh, led, jód, kafr, naftalen, ale i vonící a páchnoucí pevné látky
– Měrné skupenské teplo sublimace ls = Ls / m
– Ls závisí na teplotě, kdy látka sublimuje
Desublimace
– Přeměna látky z plynného stavu na pevné. Např. jinovatka, kdy vodní pára nesublimuje na pevné krystalky při teplotách menších, než 0C
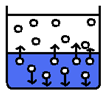
Sytá pára
– Vzniká v uzavřené nádobě
– Prostor nad kapalinou se zasytí (obsahuje maximální možný počet molekul plynu)
– V uzavřené nádobě dochází k dynamické rovnováze à objem syté páry a kapaliny je stejný
Vlastnosti syté páry
– Je v rovnováze s kapalinou
– Neplatí Van der Walsova rovnice ani stavová rovnice (p * V / T – není konstantní)
– Tlak syté páry se při konstantní teplotě nemění s objemem
– Při rostoucí teplotě se tlak syté páry zvyšuje
– Tlak syté páry závisí pouze na chemickém složení
Vlhkost vzduchu
Absolutní vlhkost:
Ф = m / V
– udává hmotnost páry v určitém objemu.
Relativní vlhkost:
fí = Ф / Фm
Podíl absolutní vlhkosti / vlhkostí, kdy je vodní pára ve vzduchu sytou parou
A….trojný bod à je to stav, kdy pevná látka, kapalina i plynná látka jsou v dynamické rovnováze
K … kritický bod à je to poslední bod křivky, ve kterém jde určit, zda se jedná o plynnou látku nebo kapalinu